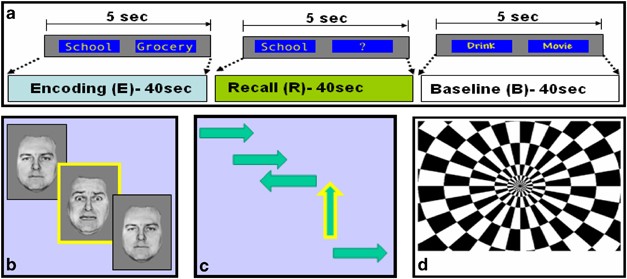
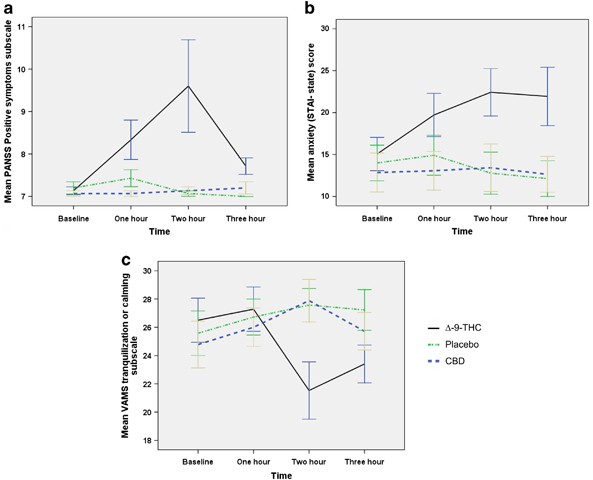
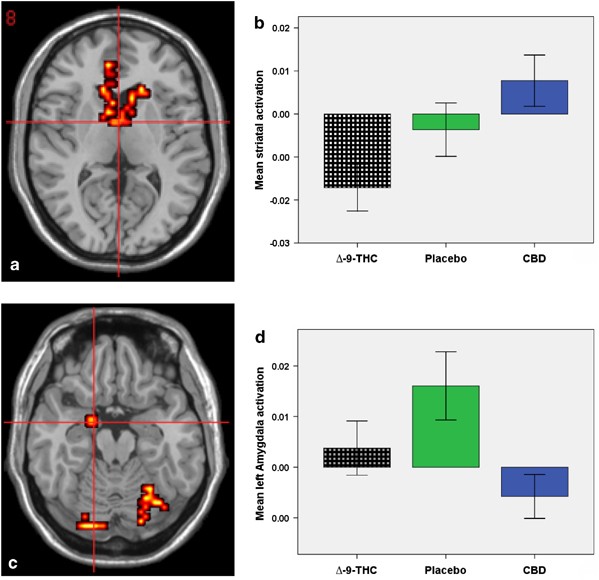
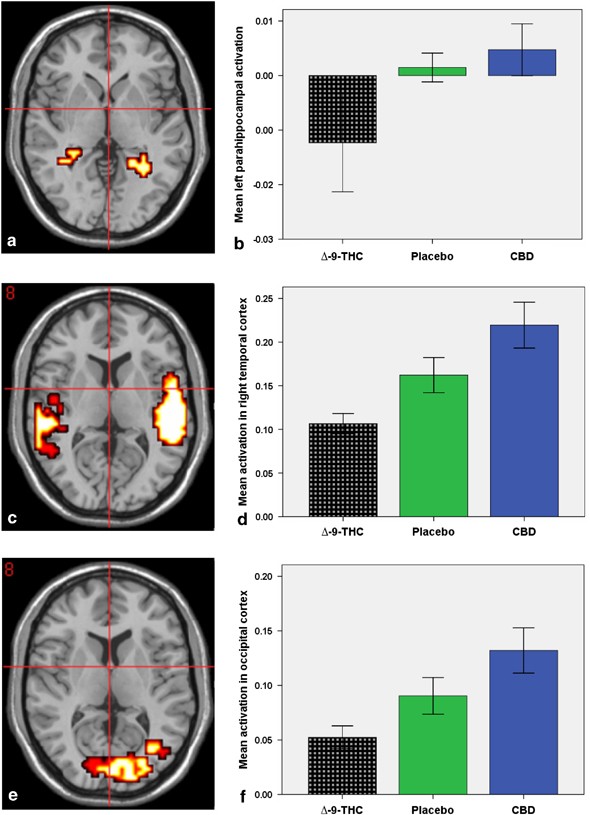
Détails sur l'étude :
Effets opposés du δ-9-tétrahydrocannabinol et du cannabidiol sur la fonction cérébrale humaine et la psychopathologie | Neuropsychopharmacologie (nature.com)
Références
-
Bhattacharyya S, Fusar-Poli P, Borgwardt S, Martin-Santos R, Nosarti C, O’Carroll C et coll. (2009). Modulation de la fonction médiotemporale et ventrostriatale chez l’homme par le delta9-tétrahydrocannabinol: une base neurale pour les effets de Cannabis sativa sur l’apprentissage et la psychose. Arch Gen Psychiatry 66: 442-451.
-
Borgwardt SJ, Allen P, Bhattacharyya S, Fusar-Poli P, Crippa JA, Seal ML et coll. (2008). Base neurale du delta-9-tétrahydrocannabinol et du cannabidiol: effets pendant l’inhibition de la réponse. Biol Psychiatry 64: 966-973.
-
Breiter HC, Etcoff NL, Whalen PJ, Kennedy WA, Rauch SL, Buckner RL et coll. (1996). Réponse et accoutumance de l’amygdale humaine pendant le traitement visuel de l’expression faciale. Neuron 17: 875-887.
-
Bullmore E, Long C, Suckling J, Fadili J, Calvert G, Zelaya F et coll. (2001). Bruit coloré et inférence computationnelle dans l’analyse de séries chronologiques neurophysiologiques (IRMf): méthodes de rééchantillonnage dans les domaines temporel et ondelette. Hum Brain Mapp 12: 61-78.
-
Cabeza R, St Jacques P (2007). Neuroimagerie fonctionnelle de la mémoire autobiographique. Trends Cogn Sci 11: 219–227.
-
Crippa JA, Zuardi AW, Garrido GE, Wichert-Ana L, Guarnieri R, Ferrari L et al (2004). Effets du cannabidiol (CBD) sur le flux sanguin cérébral régional. Neuropsychopharmacology 29: 417-426.
-
Dalton WS, Martz R, Lemberger L, Rodda BE, Forney RB (1976). Influence du cannabidiol sur les effets du delta-9-tétrahydrocannabinol. Clin Pharmacol Ther 19: 300–309.
-
Doeller CF, King JA, Burgess N (2008). Systèmes striataux et hippocampiques parallèles pour les repères et les limites de la mémoire spatiale. Proc Natl Acad Sci USA 105: 5915–5920.
-
D’Souza DC, Perry E, MacDougall L, Ammerman Y, Cooper T, Wu YT et coll. (2004). Les effets psychotomimétiques du delta-9-tétrahydrocannabinol intraveineux chez les individus en bonne santé: implications pour la psychose. Neuropsychopharmacology 29: 1558-1572.
-
D’Souza DC, Abi-Saab WM, Madonick S, Forselius-Bielen K, Doersch A, Braley G et coll. (2005). Effets du delta-9-tétrahydrocannabinol dans la schizophrénie: implications pour la cognition, la psychose et la dépendance. Biol Psychiatry 57: 594-608.
-
D’Souza DC, Braley G, Blaise R, Vendetti M, Oliver S, Pittman B et coll. (2008). Effets de l’halopéridol sur les effets comportementaux, subjectifs, cognitifs, moteurs et neuroendocriniens du delta-9-tétrahydrocannabinol chez l’homme. Psychopharmacology (Berl) 198: 587-603.
-
Elphick MR, Egertova M (2001). La neurobiologie et l’évolution de la signalisation cannabinoïde. Philos Trans R Soc Lond B Biol Sci 356: 381–408.
-
Fadda P, Robinson L, Fratta W, Pertwee RG, Riedel G (2004). Effets différentiels des extraits de cannabis riches en THC ou en CBD sur la mémoire de travail chez le rat. Neuropharmacology 47: 1170-1179.
-
Fleck MS, Daselaar SM, Dobbins IG, Cabeza R (2006). Rôle des régions cingulaires préfrontales et antérieures dans les processus de prise de décision partagés par les tâches mémoire et non mémorielles. Cereb Cortex 16: 1623-1630.
-
Folstein MF, Luria R (1973). Fiabilité, validité et application clinique de l’échelle de l’humeur visuelle analogique. Psychol Med 3: 479-486.
-
Fusar-Poli P, Crippa JA, Bhattacharyya S, Borgwardt SJ, Allen P, Martin-Santos R et coll. (2009). Effets distincts du Δ9-tétrahydrocannabinol et du cannabidiol sur les acti neuraux. Arch Gen Psychiatry 66: 95-105.
-
Hall W, Solowij N (1998). Effets néfastes du cannabis. Lancet 352: 1611-1616.
-
Hampson AJ, Grimaldi M, Axelrod J, Wink D (1998). Le cannabidiol et le (-)delta9-tétrahydrocannabinol sont des antioxydants neuroprotecteurs. Proc Natl Acad Sci USA 95: 8268–8273.
-
Haxby JV, Grady CL, Horwitz B, Ungerleider LG, Mishkin M, Carson RE et coll. (1991). Dissociation des voies de traitement visuel de l’objet et de l’espace dans le cortex extrastrié humain. Proc Natl Acad Sci USA 88: 1621–1625.
-
Ilan AB, Gevins A, Coleman M, ElSohly MA, de Wit H (2005). Profil neurophysiologique et subjectif de la marijuana avec des concentrations variables de cannabinoïdes. Behav Pharmacol 16: 487-496.
-
Karniol IG, Carlini EA (1973). Interaction pharmacologique entre le cannabidiol et le delta 9-tétrahydrocannabinol. Psychopharmacologia 33: 53-70.
-
Karniol IG, Shirakawa I, Kasinski N, Pfeferman A, Carlini EA (1974). Le cannabidiol interfère avec les effets du delta 9-tétrahydrocannabinol chez l’homme. Eur J Pharmacol 28: 172-177.
-
Kay SR, Fiszbein A, Opler LA (1987). L’échelle des syndromes positifs et négatifs (PANSS) pour la schizophrénie. Schizophr Bull 13: 261-276.
-
Lastres-Becker I, Molina-Holgado F, Ramos JA, Mechoulam R, Fernandez-Ruiz J (2005). Les cannabinoïdes offrent une neuroprotection contre la toxicité de la 6-hydroxydopamine in vivo et in vitro : pertinence pour la maladie de Parkinson. Neurobiol Dis 19: 96-107.
-
Matsuda LA, Lolait SJ, Brownstein MJ, Young AC, Bonner TI (1990). Structure d’un récepteur cannabinoïde et expression fonctionnelle de l’ADNc cloné. Nature 346: 561-564.
-
McDonald J, Schleifer L, Richards JB, de Wit H (2003). Effets du THC sur les mesures comportementales de l’impulsivité chez l’homme. Neuropsychopharmacology 28: 1356-1365.
-
McLellan AT, Kushner H, Metzger D, Peters R, Smith I, Grissom G et coll. (1992). La cinquième édition de l’Indice de gravité de la toxicomanie. J Subst Abuse Treat 9: 199-213.
-
Mechoulam R, Peters M, Murillo-Rodriguez E, Hanus LO (2007). Cannabidiol—progrès récents. Chem Biodivers 4: 1678-1692.
-
Mechoulam R, Spatz M, Shohami E (2002). Endocannabinoïdes et neuroprotection. Sci STKE 2002: RE5.
-
Moore TH, Zammit S, Lingford-Hughes A, Barnes TR, Jones PB, Burke M et coll. (2007). Consommation de cannabis et risque de résultats psychotiques ou affectifs sur la santé mentale : une revue systématique. Lancet 370: 319-328.
-
Morgan CJ, Curran HV (2008). Effets du cannabidiol sur les symptômes schizophréniques chez les personnes qui consomment du cannabis. Br J Psychiatry 192: 306-307.
-
Morris JS, Frith CD, Perrett DI, Rowland D, Young AW, Calder AJ et coll. (1996). Une réponse neuronale différentielle dans l’amygdale humaine aux expressions faciales craintives et heureuses. Nature 383: 812-815.
-
Nelson HE (1982). National Adult Reading Test (NART) : Manuel de test. NFER-Nelson : Windsor.
-
O’Leary DS, Block RI, Koeppel JA, Flaum M, Schultz SK, Andreasen NC et coll. (2002). Effets de fumer de la marijuana sur la perfusion cérébrale et la cognition. Neuropsychopharmacology 26: 802-816.
-
Pertwee RG (2008). La pharmacologie diversifiée des récepteurs CB1 et CB2 de trois cannabinoïdes végétaux : delta9-tétrahydrocannabinol, cannabidiol et delta9-tétrahydrocannabivarine. Br J Pharmacol 153: 199–215.
-
Phan KL, Angstadt M, Golden J, Onyewuenyi I, Popovska A, de Wit H (2008). Modulation cannabinoïde de la réactivité de l’amygdale aux signaux sociaux de menace chez l’homme. J Neurosci 28: 2313-2319.
-
Potter DJ, Clark P, Brown MB (2008) Puissance du delta 9-THC et d’autres cannabinoïdes dans le cannabis en Angleterre en 2005: implications pour la psychoactivité et la pharmacologie. J Forensic Sci 53: 90–94
-
Price CJ, Wise RJ, Warburton EA, Moore CJ, Howard D, Patterson K et coll. (1996). Entendre et dire. La neuro-anatomie fonctionnelle du traitement de texte auditif. Cerveau 119 (Pt 3): 919-931.
-
Ramaekers JG, Moeller MR, van Ruitenbeek P, Theunissen EL, Schneider E, Kauert G (2006). Cognition et contrôle moteur en fonction de la concentration de Delta9-THC dans le sérum et le liquide buccal : limites de l’affaiblissement des facultés. Drug Alcohol Depend 85: 114–122.
-
Rubia K, Russell T, Overmeyer S, Brammer MJ, Bullmore ET, Sharma T et coll. (2001). Cartographie de l’inhibition motrice : activations cérébrales conjonctives à travers différentes versions de tâches go/no-go et stop. Neuroimage 13: 250-261.
-
Sarne Y, Mechoulam R (2005). Les cannabinoïdes : entre neuroprotection et neurotoxicité. Curr Drug Targets CNS Neurol Disord 4: 677–684.
-
Simons JS, Gilbert SJ, Owen AM, Fletcher PC, Burgess PW (2005). Rôles distincts du cortex préfrontal antérieur latéral et médian dans le souvenir contextuel. J Neurophysiol 94: 813-820.
-
Spielberger C (1983). Manuel de l’inventaire de l’anxiété des traits d’état. Consulting Psychologists Press Inc: Palo Alto, CA.
-
Talairach J, Tournoux P (1988). Atlas stéréotaxique co-planaire du cerveau humain. Thieme Medical: New York.
-
Tart CT (1970). Expériences courantes d’intoxication à la marijuana. Nature 226: 701-704.
-
Viveros MP, Llorente R, Moreno E, Marco EM (2005). Effets comportementaux et neuroendocriniens des cannabinoïdes dans les périodes critiques du développement. Behav Pharmacol 16: 353-362.
-
Zuardi AW (2008). Cannabidiol: d’un cannabinoïde inactif à un médicament à large spectre d’action. Rev Bras Psiquiatr 30: 271-280.
-
Zuardi AW, Cosme RA, Graeff FG, Guimaraes FS (1993). Effets de l’ipsapirone et du cannabidiol sur l’anxiété expérimentale humaine. J Psychopharmacol 7: 82-88.
-
Zuardi AW, Shirakawa I, Finkelfarb E, Karniol IG (1982). Action du cannabidiol sur l’anxiété et d’autres effets produits par le delta 9-THC chez des sujets normaux. Psychopharmacology (Berl) 76: 245-250.
-
Zuardi AW, Hallak JE, Dursun SM, Morais SL, Sanches RF, Musty RE et al (2006). Cannabidiol en monothérapie pour la schizophrénie résistante au traitement. J Psychopharmacol 20: 683-686.