Présentation détaillée de l'étude
Introduction
Récemment, il y a eu un intérêt croissant pour le cannabidiol (CBD) en tant que substance thérapeutique, en raison de ses effets antipsychotiques, anxiolytiques et anti-fringales putatifs (Iseger et Bossong, 2015; Rohleder et coll., 2016; Batalla et coll., 2019). Le CBD est l’un des plus de 100 cannabinoïdes pouvant être dérivés de la plante de cannabis et est, contrairement au principal composé psychoactif delta-9-tétrahydrocannabinol (THC), dépourvu d’effets enivrants (Freeman et al., 2019). Étant donné que la plupart des traitements conventionnels en psychiatrie, comme les antipsychotiques et les antidépresseurs, sont associés à des taux de réponse limités et à des événements indésirables qui limitent souvent la tolérabilité et l’observance (Blessing et coll., 2015; Samara et coll., 2019), il existe un besoin urgent de mettre au point de nouveaux traitements pharmaceutiques (Leucht et coll., 2013; Blessing et coll., 2015; Lally et MacCabe, 2015). À cet égard, le CBD a été proposé comme nouveau composé thérapeutique dans plusieurs troubles psychiatriques, tels que la psychose (Iseger et Bossong, 2015; Batalla et coll., 2019), les troubles anxieux (Blessing et coll., 2015), les troubles liés à l’utilisation de substances (Chye et coll., 2019; Freeman et coll., 2020) et les troubles du spectre autistique (Poleg et coll., 2019; Fusar-Poli et coll., 2020).
Les effets du CBD sont très probablement liés au système endocannabinoïde (Rohleder et al., 2016), bien que son mécanisme d’action précis ne soit pas encore entièrement compris. Des études animales ont montré que le CBD n’a pas d’affinité significative avec les récepteurs cannabinoïdes CB1 et CB2 (Bisogno et coll., 2001; Jones et coll., 2010), mais peut agir comme antagoniste des deux en présence de CB1 agonistes (Thomas et coll., 2007). Il a été émis l’hypothèse que les effets antagonistes du CBD pourraient être dus à une modulation allostérique négative du CB1 (Laprairie et coll., 2015; Rohleder et coll., 2016). D’autres cibles moléculaires suggérées comprennent différents types de récepteurs, tels que la sérotonine de type 1A (5HT1A), le récepteur gamma activé par les proliférateurs de peroxysomes (PPARgamma), le récepteur vanilloïde 1 (TRPV1), le GPR55 et le GPR18 (Pertwee, 2008; Gururajan et Malone, 2016). En outre, il a été démontré que le CBD augmente les taux plasmatiques du cannabinoïde endogène anandamide, ce qui est lié à ses effets antipsychotiques (Leweke et al., 2012). Par conséquent, le CBD peut exercer un effet protecteur sur les perturbations du système endocannabinoïde, comme observé dans plusieurs troubles psychiatriques (Leweke et al., 2007; Morgan et coll., 2013; Minichino et coll., 2019).
Les techniques de neuroimagerie fournissent un aperçu très utile des processus neuronaux humains impliqués dans les effets comportementaux des cannabinoïdes. Un nombre croissant d’études de neuroimagerie ont été réalisées pour examiner les mécanismes neuronaux humains sous-jacents aux effets du CBD. Bien que certaines de ces études aient été incluses dans d’excellentes revues qui décrivent l’impact du cannabis sur le fonctionnement du cerveau humain dans un contexte plus large (Martín-Santos et coll., 2010; Bhattacharyya et coll., 2012a; Batalla et coll., 2014; Weinstein et al., 2016), l’objectif de la présente revue est de fournir un aperçu systématique et à jour des études de neuroimagerie qui ont étudié les effets du CBD sur la fonction cérébrale humaine. Cela comprend des études qui ont examiné l’impact du CBD sur la fonction cérébrale de volontaires sains, comprenant à la fois les effets aigus du CBD seul ainsi qu’en comparaison directe avec ceux induits par le THC, et des études qui ont étudié les substrats neuronaux des effets aigus du CBD chez les patients atteints d’un trouble psychiatrique.
Méthodologie
Stratégie de recherche
Cette revue a été menée conformément à l’énoncé PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses) (Moher et coll., 2009). PubMed a été recherché pour des études de neuroimagerie portant sur l’impact du CBD sur la fonction cérébrale humaine publiées jusqu’en mai 2020. Voir pour la syntaxe de recherche Pubmed exacte les méthodes supplémentaires. Les références bibliographiques ont été examinées pour d’autres études pertinentes.
Inclusion des données
Les titres et les résumés ont été sélectionnés à l’aveugle pour leur éligibilité par deux auteurs (AB et JB). Les divergences ont été discutées avec un troisième auteur (MB). Les critères d’inclusion étaient: 1) l’utilisation de techniques de neuroimagerie et 2) l’administration de CBD à des sujets humains. Les examens et les rapports de cas ont été exclus.
Extraction de données
L’extraction des données comprenait : l’information sur l’étude (p. ex. titre, auteurs, plan d’étude); les caractéristiques de l’échantillon (âge moyen, sexe, handedness); dose de cannabinoïdes et voie d’administration; intervalle de temps entre l’administration et l’imagerie; modalité d’imagerie; tâche cognitive effectuée pendant l’imagerie; et le degré de chevauchement de l’échantillon.
Résultats
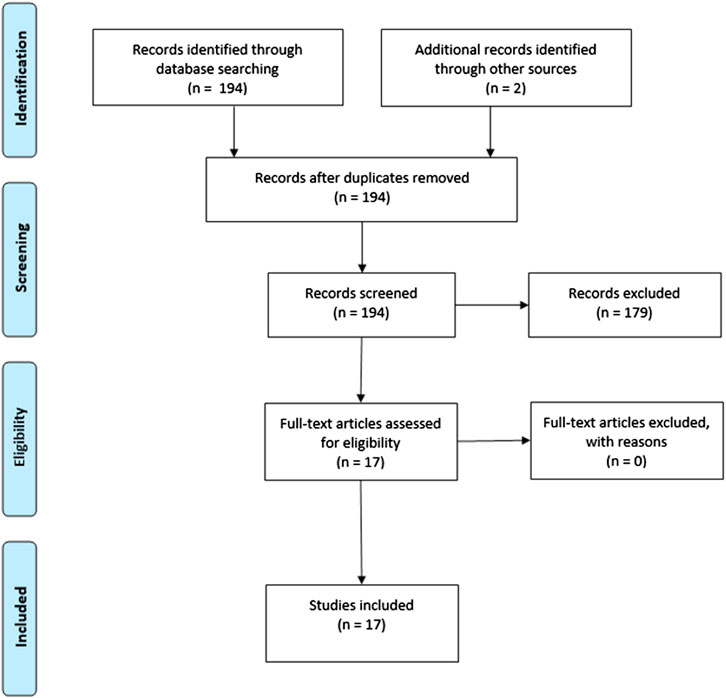
La stratégie de recherche a produit 194 études, dont 15 répondaient aux critères d’inclusion. Deux études ont été trouvées par des références supplémentaires, ce qui a donné un total de 17 études incluses (Figure 1). Au total, la présente revue comprenait 115 sujets sains, 33 personnes à risque clinique élevé (CHR) de psychose, 13 patients atteints d’un trouble psychotique, 10 patients atteints de trouble anxieux et 17 patients atteints d’un trouble du spectre autistique.
GRAPHIQUE 1. Organigramme PRISMA.
Chez des sujets sains, 12 études ont rapporté les effets aigus du CBD par rapport au placebo (Crippa et al., 2004; Borgwardt et coll., 2008; Bhattacharyya et coll., 2009; Fusar-Poli et coll., 2009; Fusar-Poli et coll., 2010) ou comparé au THC (Bhattacharyya et coll., 2010; Winton-Brown et coll., 2011; Bhattacharyya et coll., 2012b; Bhattacharyya et coll., 2015; Freeman et coll., 2018; Grimm et coll., 2018; Wall et coll., 2019). Chez les personnes atteintes d’un trouble psychiatrique, cinq études ont évalué les effets aigus du CBD par rapport à un placebo (Crippa et al., 2011 ; Bhattacharyya et coll., 2018; Pretzsch et coll., 2019; Wilson et coll., 2019; O’Neill et coll., 2020).
Un groupe de huit études a effectué différentes tâches cognitives (c.-à-d. go-no go, apprentissage verbal, traitement émotionnel, traitement visuel et auditif) en utilisant le même échantillon de sujets sains (Borgwardt et coll., 2008; Bhattacharyya et coll., 2009; Fusar-Poli et coll., 2009; Bhattacharyya et coll., 2010; Fusar-Poli et coll., 2010; Winton-Brown et coll., 2011; Bhattacharyya et coll., 2012b; Bhattacharyya et coll., 2015). De plus, les études de Freeman et al. (2018) et de Wall et al. (2019) ont utilisé un échantillon chevauchant de participants en bonne santé, et celles de Bhattacharyya et al. (2018) et Wilson et al. (2019) une cohorte similaire de personnes CHR . Voir les tableaux 1 à 3 pour les caractéristiques des études et les résultats des études incluses dans la revue systématique actuelle.
TABLEAU 1. Les effets aigus du CBD sur la fonction cérébrale de volontaires sains.
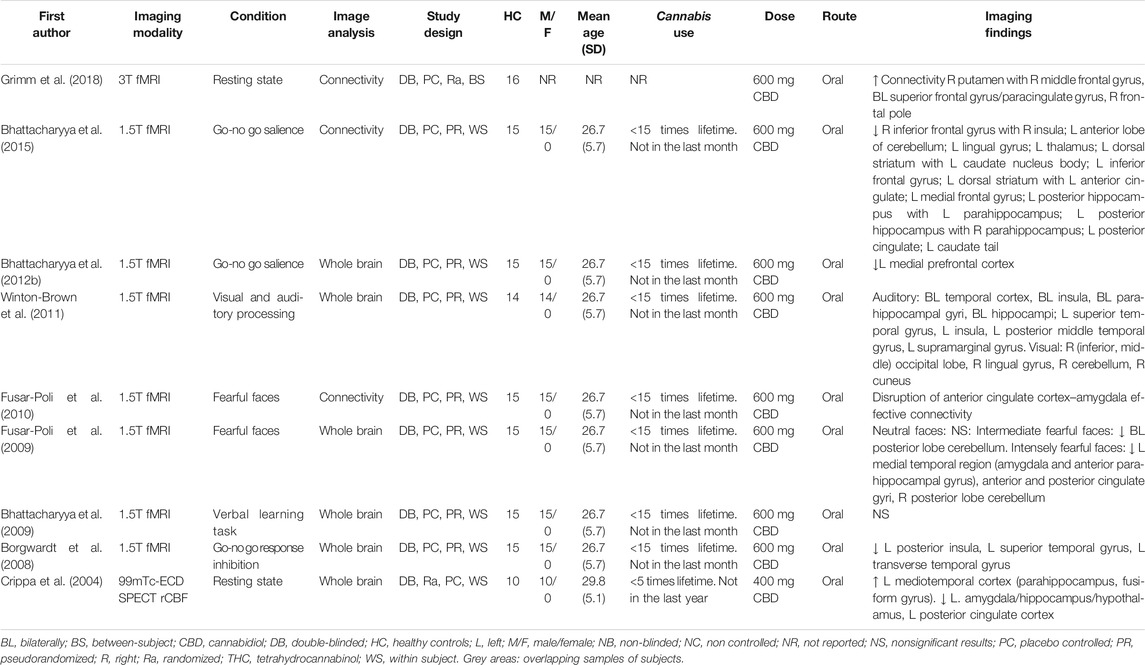
TABLEAU 2. Les effets aigus du CBD par rapport au THC sur la fonction cérébrale de volontaires sains.
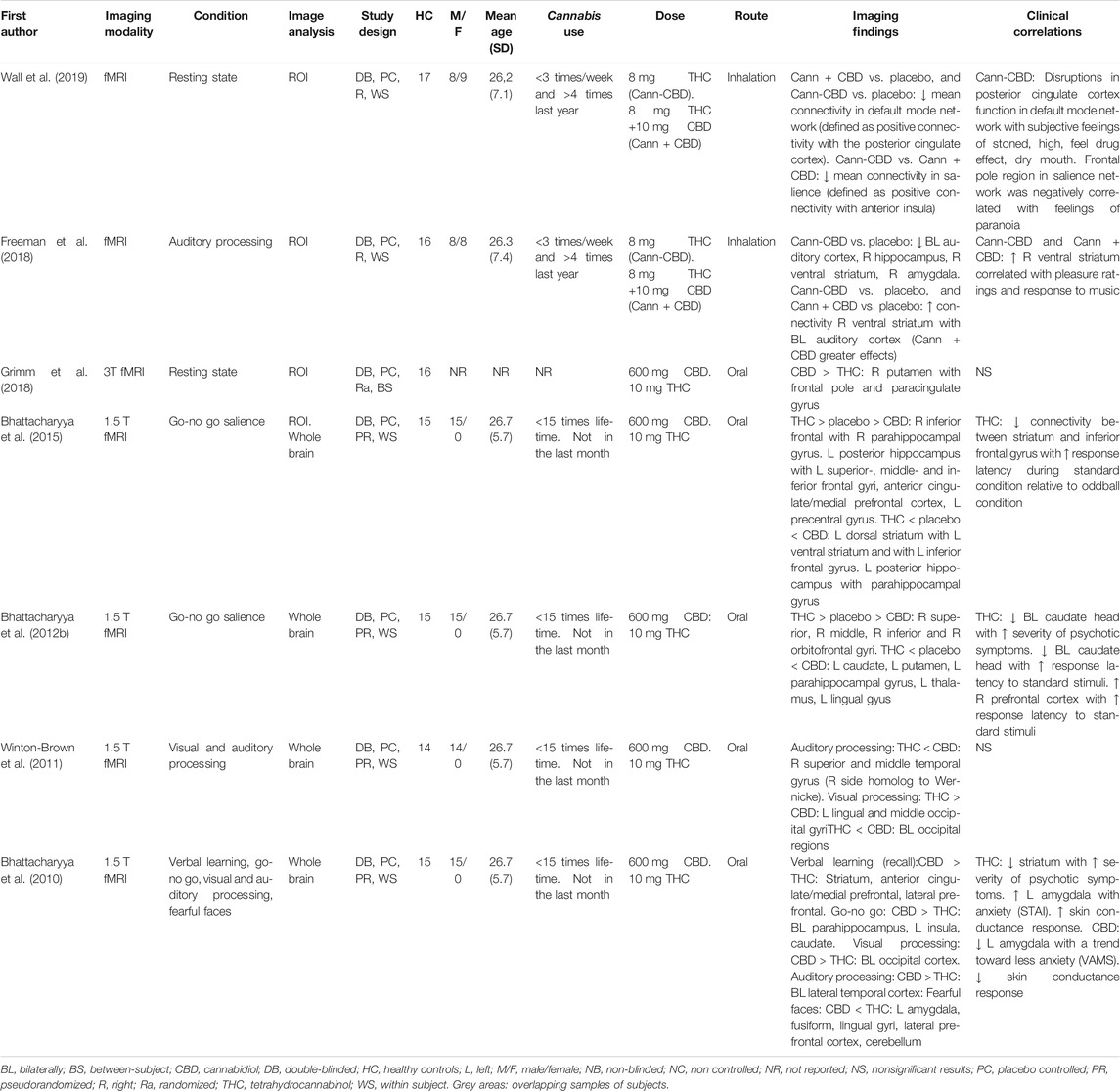
TABLEAU 3. Les effets aigus du CBD sur la fonction cérébrale des patients atteints d’un trouble psychiatrique.
Effets aigus du CBD sur la fonction cérébrale de volontaires en bonne santé
Neuf études en double aveugle contrôlées par placebo ont examiné les effets aigus du CBD sur la fonction cérébrale de volontaires sains. L’une de ces études a utilisé la tomodensitométrie par émission monophotonique (TEMP) mesurant le débit sanguin cérébral régional, tandis que huit études ont appliqué l’imagerie par résonance magnétique fonctionnelle (IRMf), soit au repos, soit pendant l’exécution d’une tâche cognitive (tableau 1).
État de repos
Deux études ont examiné les effets aigus du CBD au repos (Crippa et coll., 2004; Grimm et coll., 2018). Crippa et coll. (2004) ont mesuré le débit sanguin cérébral à l’aide de 99mDimère de cystéinate de tc-éthyle (99mTc-ECD) imagerie TEMP chez 10 volontaires mâles en bonne santé à l’aide d’un plan croisé (Crippa et coll., 2004). L’administration d’une dose orale de 400 mg de CBD a amélioré le flux sanguin par rapport au placebo dans une zone constituée du gyrus parahippocampique gauche et fusiforme. Inversement, le CBD a atténué le flux sanguin dans le cortex cingulaire postérieur gauche et dans un groupe comprenant l’amygdale gauche, l’hippocampe, l’uncus et l’hypothalamus (Crippa et al., 2004). Dans une autre étude sur l’état de repos utilisant l’IRMf pour mesurer la connectivité, 16 volontaires masculins en bonne santé ont reçu un placebo, 10 mg de THC par voie orale et 600 mg de CBD par voie orale en utilisant un plan d’étude croisé (Grimm et al., 2018). Le striatum a été défini comme une région de semence et une analyse du cerveau entier a été effectuée. Le CBD a augmenté la connectivité entre le putamen droit et trois grappes, situées principalement dans le cortex préfrontal droit (Grimm et al., 2018).
Tâches cognitives
Sept études ont effectué différentes tâches cognitives (c.-à-d. go-no go, apprentissage verbal, traitement émotionnel, traitement visuel et auditif) en utilisant le même échantillon de 15 volontaires en bonne santé (Borgwardt et al., 2008; Bhattacharyya et coll., 2009; Fusar-Poli et coll., 2009; Fusar-Poli et coll., 2010; Winton-Brown et coll., 2011; Bhattacharyya et coll., 2012b; Bhattacharyya et coll., 2015). Les auteurs ont exploré les effets aigus de 600 mg de CBD, 10 mg de THC et d’un placebo sur l’activité cérébrale mesurée par IRMf en utilisant un plan croisé en double aveugle. Au cours des séances, des évaluations de l’anxiété (STAI), de l’intoxication (AIS), des symptômes psychotiques (PANNS) et des sentiments subjectifs (VAMS) ont été obtenues. Les effets aigus du CBD en comparaison directe avec ceux induits par l’administration de THC sont décrits dans la section suivante.
Une tâche go-no go a été utilisée pour étudier l’activité cérébrale pendant l’inhibition de la réponse et la détection de stimuli saillants (Borgwardt et coll., 2008; Bhattacharyya et coll., 2012b). Dans des conditions d’inhibition de la réponse, le CBD a atténué l’activité cérébrale par rapport au placebo dans l’insula postérieure gauche, le gyrus temporal supérieur gauche et le gyrus temporal transverse gauche (Borgwardt et al., 2008). Au cours de la présentation d’un saillant relatif à un stimulus non saillant, l’activité du CBD a été atténuée dans le cortex préfrontal médian gauche (Bhattacharyya et al., 2012b). Dans le même rapport à la comparaison des stimuli non saillants, Bhattacharyya et al. (2015) ont effectué des analyses de connectivité avec le gyrus frontal inférieur, le striatum dorsal et l’hippocampe postérieur définis comme régions de semence. Par rapport au placebo, une diminution de la connectivité du CBD a été observée entre les zones suivantes: le gyrus frontal inférieur droit et l’insula droite, le cervelet gauche, le gyrus lingual gauche et le thalamus gauche; le striatum dorsal gauche et le gyrus frontal antérieur gauche et médian gauche; l’hippocampe postérieur gauche et le parahippocampe droit, le gyrus cingulaire postérieur gauche et la queue caudée. Inversement, le CBD a augmenté la connectivité entre les zones suivantes: le striatum dorsal gauche et le corps gauche du noyau caudé et le gyrus frontal inférieur gauche; hippocampe postérieur gauche et parahippocampe gauche (Bhattacharyya et al., 2015).
La tâche d’apprentissage verbal consistait en un bloc d’encodage, où les participants devaient évaluer si des paires de mots s’emboîtaient bien, et un bloc de rappel, au cours duquel les participants faisaient correspondre le présenté avec le mot précédemment associé (Bhattacharyya et al., 2009). Activation modulée par le CBD dans des conditions de codage dans l’insula, le gyrus temporal moyen, le gyrus lingual, le gyrus précunéus et le gyrus précentral. Pendant le rappel, le CBD a modulé l’activation dans l’hippocampe. Cependant, aucun de ces résultats n’était statistiquement significatif (Bhattacharyya et coll., 2009).
La tâche de traitement émotionnel consistait en une série de visages, y compris des visages neutres, intermédiaires et extrêmement craintifs (Fusar-Poli et al., 2009). Par rapport au placebo, l’administration de CBD n’a pas modifié l’activité cérébrale lors de la présentation de visages neutres. Lors de la présentation de visages moyennement craintifs, le CBD a atténué l’activité bilatérale dans le lobe postérieur du cervelet. Au cours du traitement des visages intensément craintifs, le CBD a atténué l’activité dans la région temporale médiale gauche (amygdale et gyrus parahippocampique antérieur), le gyri cingulaire antérieur et postérieur et le lobe postérieur droit du cervelet (Fusar-Poli et al., 2009). De plus, le CBD a diminué le nombre de fluctuations de la réponse de conductance cutanée, une mesure physiologique de la réponse émotionnelle. De plus, cette diminution de la réponse de conductance cutanée covariait avec l’atténuation de l’activité de l’amygdale gauche et du cingulaire antérieur (Fusar-Poli et coll., 2009). Sur la base de ces résultats, Fusar-Poli et al. (2010) ont étudié la connectivité entre ces deux régions dans le même échantillon. Par rapport au placebo, l’administration de CBD a perturbé la connectivité entre le cortex cingulaire antérieur gauche et l’amygdale gauche tout en regardant des visages effrayés (Fusar-Poli et al., 2010).
En écoutant des mots neutres, l’activité cérébrale a été augmentée pendant le CBD par rapport au placebo dans le cortex temporal bilatéral, l’insula, le gyrus parahippocampique et l’hippocampe (Winton-Brown et al., 2011). Inversement, le CBD a atténué l’activité dans le gyrus temporal supérieur gauche, l’insula, le gyrus temporal moyen postérieur et le gyrus supramarginal. Pendant la stimulation visuelle, le CBD a augmenté l’activité dans le lobe occipital droit, le gyrus lingual, le cervelet et le cunéus (Winton-Brown et al., 2011).
En résumé, le CBD a amélioré la connectivité fronto-striatale et diminué l’activité limbique pendant l’état de repos, et a modulé l’activité cérébrale montrant des modèles spécifiques à la tâche au cours de différents paradigmes cognitifs. Par exemple, le CBD a augmenté l’activation par rapport au placebo dans le parahippocampe pendant le traitement auditif et réduit l’activation dans cette région pendant le traitement des visages craintifs. De plus, le CBD a diminué la connectivité entre les régions fronto-limbiques (c.-à-d. le cortex cingulaire antérieur et l’amygdale) pendant le traitement des visages effrayants et a amélioré la connectivité fronto-limbique-striatale (c.-à-d. gyrus frontal inférieur, striatum dorsal et hippocampe postérieur) pendant le traitement de saillance.
Effets aigus du CBD par rapport au THC sur la fonction cérébrale de volontaires en bonne santé
Sept études IRMf ont examiné les effets aigus du CBD en comparaison directe avec ceux induits par le THC, pendant l’état de repos ou une tâche cognitive. Certaines études ont analysé des régions du cerveau où le CBD et le THC ont montré une activité opposée par rapport au placebo, tandis que d’autres ont directement comparé les deux substances (Tableau 2).
État de repos
Grimm et al. (2018) ont effectué une analyse de connectivité de l’état de repos sur 16 volontaires sains, où les régions du striatum et de la façade ont été définies comme régions d’intérêt. Alors que le CBD a amélioré la connectivité frontale-striatale, le THC n’a pas modifié cette connectivité de manière significative, peut-être en raison de faibles concentrations plasmatiques de THC pendant le scan. La comparaison directe entre les deux substances a montré que le CBD augmentait la connectivité par rapport au THC entre le putamen droit et le pôle frontal et le gyrus paracingulaire (Grimm et al., 2018).
Dans une étude à double insu, pseudo-randomisée, intra-sujet, Wall et al. (2019) ont étudié les effets sur la connectivité fonctionnelle au repos de deux souches de cannabis inhalé, contenant du THC (8 mg) sans ou avec du CBD (10 mg), et un placebo chez 17 consommateurs occasionnels de cannabis. Des analyses de connectivité ont été effectuées pour étudier le réseau en mode par défaut (défini comme une connectivité positive avec le cortex cingulaire postérieur), le réseau de contrôle exécutif (défini comme une connectivité négative avec le cortex cingulaire postérieur) et la saillance (définie comme une connectivité positive avec l’insula antérieure). Les deux souches de cannabis ont montré une réduction significative de la connectivité moyenne dans le réseau en mode par défaut par rapport au placebo. Dans le réseau de saillance, le cannabis contenant à la fois du THC et du CBD a provoqué une augmentation significative de la connectivité par rapport au cannabis sans CBD, mais les deux souches ne différaient pas significativement du placebo. Aucun effet significatif n’a été observé dans le réseau de contrôle exécutif (Wall et al., 2019). Des corrélations significatives entre les mesures subjectives de la sensation de l’effet de la drogue et les effets cérébraux n’ont été trouvées qu’après l’administration de cannabis sans CBD. Ces corrélations impliquaient la région du cortex cingulaire postérieur et la région du pôle frontal (Wall et al., 2019).
Tâches cognitives
Freeman et al. (2018) ont étudié les effets aigus du cannabis inhalé avec et sans CBD, tout en écoutant de la musique classique et du son brouillé, en utilisant le même échantillon de consommateurs occasionnels de cannabis que celui décrit par Wall et al. (2019). Les deux types de cannabis ont augmenté les cotes de vouloir écouter de la musique et amélioré la perception sonore. L’inhalation de cannabis sans CBD par rapport au placebo a entraîné une réponse bilatérale atténuée à la musique dans le cortex auditif, l’hippocampe droit, le striatum ventral droit et l’amygdale droite. Le cannabis avec CBD n’a pas modulé significativement l’activité par rapport au placebo ou au cannabis sans CBD. Sur toutes les sessions, l’activation dans le striatum ventral droit était corrélée avec les cotes de plaisir et la réponse à la musique. De plus, cette région a montré une connectivité fonctionnelle accrue avec le cortex auditif bilatéral pendant la musique par rapport au son brouillé. Le cannabis avec CBD a eu un impact plus important sur la connectivité fonctionnelle entre ces deux régions par rapport au cannabis sans CBD (Freeman et al., 2018).
L’autre série de quatre études a effectué différentes tâches cognitives (c.-à-d. go-no go, apprentissage verbal, traitement émotionnel, traitement visuel et auditif) dans un plan croisé en double aveugle de 600 mg de CBD, 10 mg de THC et un placebo, en utilisant le même échantillon de 15 volontaires sains que décrit par Borgwardt et al. (2008).
Au cours d’une tâche de traitement émotionnel, le CBD et le THC ont eu des effets opposés par rapport au placebo dans l’amygdale gauche, le gyri fusiforme et lingual, le cortex préfrontal latéral et le cervelet (Bhattacharyya et al., 2010). L’activité accrue dans l’amygdale gauche après l’administration de THC covariait avec le niveau d’anxiété évalué par la STAI, tandis que l’activité atténuée après le CBD dans l’amygdale était corrélée à son effet anxiolytique mesuré par le VAMS. Des effets opposés sur les fluctuations de la réponse de conductance cutanée ont également été observés après l’administration de THC par rapport au CBD (Bhattacharyya et coll., 2010).
Au cours de la phase de rappel d’une tâche de mémoire verbale, le CBD a augmenté et réduit l’activité cérébrale dans le striatum (Bhattacharyya et al., 2010). La réduction de l’activité du striatum après l’administration de THC était corrélée à la gravité des symptômes psychotiques. De plus, au cours de la phase de rappel, des effets opposés ont été observés dans un groupe constitué du cortex cingulaire antérieur et préfrontal médian et du cortex préfrontal latéral (Bhattacharyya et coll., 2010).
Au cours de l’inhibition de la réponse, le CBD a augmenté et le THC a réduit l’activité dans l’insula gauche, le gyrus caudé gauche et le gyrus parahippocampique bilatéral (Bhattacharyya et al., 2010). Au cours d’une tâche go-no go, le CBD s’est atténué et le THC a augmenté l’activité dans le gyri supérieur droit, moyen, inférieur et orbifrontal par rapport au placebo (Bhattacharyya et al., 2012b). Inversement, dans le caudé gauche, le putamen, le gyrus parahippocampique, le thalamus et le gyrus lingual, l’activation était atténuée par le THC, mais augmentée par le CBD (Bhattacharyya et coll., 2012b). Bhattacharyya et al. (2015) ont effectué des analyses de connectivité sur les mêmes données avec le gyrus frontal inférieur, le striatum dorsal et l’hippocampe postérieur définis comme régions semencières. Le CBD et le THC ont modulé la connectivité fonctionnelle entre ces graines et les grappes dans le reste du cerveau dans la direction opposée (Bhattacharyya et al., 2015).
Au cours du traitement de la parole, le CBD et le THC ont montré des effets opposés par rapport au placebo dans le cortex temporal bilatéral, tandis que des effets opposés ont été trouvés dans le cortex occipital bilatéral en regardant un damier visuel (Bhattacharyya et al., 2010). Une comparaison directe des effets du CBD et du THC a révélé une activité significativement réduite après le THC dans le gyrus temporal supérieur et moyen droit pendant le traitement de la parole. Au cours du traitement visuel, le THC a augmenté l’activité par rapport au CBD dans le gyrus occipital bilatéral lingual et moyen, mais a réduit l’activité dans plusieurs autres régions occipitales. Des effets mixtes ont été signalés dans le cervelet (Winton-Brown et coll., 2011).
En résumé, le CBD et le THC ont montré des effets dissonants pendant l’état de repos et pendant plusieurs tâches cognitives. Pendant l’état de repos, le CBD a amélioré la connectivité entre les régions fronto-striatales par rapport au THC, et le cannabis avec THC et CBD a augmenté la connectivité au sein du réseau de saillance par rapport au cannabis sans CBD. Le THC et le CBD ont montré des effets opposés spécifiques à la tâche au cours du traitement émotionnel (fronto-temporal), de la mémoire verbale (fronto-striatal), de l’inhibition de la réponse (fronto-limbique-striatal) et du traitement auditif / visuel (temporo-occipital).
Les effets aigus du CBD sur la fonction cérébrale des patients atteints d’un trouble psychiatrique
Cinq études de neuroimagerie ont rapporté les effets aigus du CBD sur la fonction cérébrale chez les patients atteints d’un trouble psychiatrique. Trois de ces études ont utilisé l’IRMf : deux dans une cohorte similaire de personnes présentant un niveau clinique élevé de psychose et une dans un groupe de patients atteints de psychose établie. Une étude a utilisé la TEMP pour étudier le flux sanguin cérébral chez les patients atteints de trouble d’anxiété sociale et une étude a examiné les concentrations de métabolites à l’aide de la spectroscopie par résonance magnétique protonique (1H-MRS) chez les patients atteints de troubles du spectre autistique (tableau 3).
Bhattacharyya et coll. (2018) ont mené un essai randomisé à double insu par IRMf sur 33 sujets atteints de RSC naïfs de médicaments et 19 témoins sains, en utilisant la même tâche d’apprentissage verbal que celle décrite dans les études précédentes (Bhattacharyya et coll., 2009; Bhattacharyya et coll., 2010). Les patients ont reçu 600 mg de CBD ou un placebo, tandis que les témoins sains n’ont reçu aucun médicament. Au cours des conditions de codage, le groupe de patients ayant reçu le placebo (indiquant l’état à risque) a montré une altération de l’activité cérébrale par rapport au groupe témoin sain dans des grappes impliquant le gyrus frontal, l’insula, le claustrum, le striatum dorsal, le gyrus pré- et postcentral, le gyrus pariétal, le cervelet, le gyrus lingual, le gyrus sous-calleux, le cortex cingulaire, le précunéus et le cunéus. Au cours des conditions de rappel, le groupe de patients ayant reçu le placebo a montré une altération de l’activité cérébrale par rapport au groupe témoin sain dans des grappes comprenant le gyrus frontal, l’insula, le cunéus, le gyrus fusiforme, le gyrus lingual, le cingulaire postérieur, le cervelet, le gyrus occipital, le gyrus fusiforme, le gyrus parahippocampique, le mésencéphale, le cervelet, le thalamus et le gyrus temporal. Une comparaison linéaire entre les trois groupes (patients recevant du CBD, patients recevant un placebo et sujets témoins ne recevant aucun médicament) a révélé plusieurs groupes dans lesquels le CBD a montré une activation intermédiaire par rapport au groupe placebo et au groupe témoin sain. Par exemple, lors de l’encodage, le groupe CBD a montré une activation intermédiaire dans des amas englobant le gyrus frontal, l’insula, le striatum, le gyrus précentral, le cervelet, le gyrus fusiforme, le cortex cingulaire, le gyrus sous-calleux et le gyrus occipital. Au cours du rappel, le groupe CBD a montré une activation intermédiaire (par rapport au groupe placebo et au groupe témoin) dans des grappes comprenant le gyrus frontal, l’insula, le striatum, le gyrus précentral, le cervelet, le gyrus fusiforme, le cortex cingulaire, le gyrus occipital, le gyrus parahippocampique, le mésencéphale, le thalamus et le gyrus temporal (Bhattacharyya et al., 2018).
Wilson et al. (2019) ont effectué une tâche de retard d’incitation monétaire chez les mêmes 32 sujets naïfs de médicaments CHR et 19 témoins en bonne santé signalés par Bhattacharyya et al. (2018). Cette tâche a été utilisée pour étudier les conditions de saillance motivationnelle en comparant l’activation cérébrale pendant la récompense et la perte par rapport à l’anticipation neutre. Le groupe de patients qui ont reçu le placebo a montré une plus grande activité cérébrale par rapport au groupe témoin sain dans des grappes englobant l’opercule frontal, l’insula, l’opercule pariétal, le gyri frontal et le gyri temporal. Une comparaison linéaire entre les trois groupes a révélé une activation intermédiaire dans le groupe CBD (par rapport au groupe placebo et au groupe témoin) dans trois groupes: l’insula gauche et l’opercule pariétal, l’opercule frontal gauche et le gyrus frontal supérieur gauche (Wilson et al., 2019).
Une étude IRMf a exploré les effets du CBD sur des patients atteints de psychose établie (O’Neill et al., 2020), où 15 patients sous traitement antipsychotique ont reçu 600 mg de CBD ou un placebo en double aveugle, randomisé, dans le sujet. Dans cette étude, 19 participants en bonne santé ont été scannés mais n’ont reçu aucun médicament. Au cours de la procédure de balayage, tous les participants ont effectué une tâche d’apprentissage verbal, la même que celle utilisée dans les études décrites précédemment (Bhattacharyya et coll., 2009; Bhattacharyya et coll., 2010; Bhattacharyya et coll., 2018). Le lobe temporal médian, le cortex préfrontal et le striatum/pallidum ont été sélectionnés comme régions d’intérêt et modèles d’activation, ainsi qu’une analyse de connectivité ont été effectuées (O’Neill et coll., 2020). Les patients après administration de CBD ont montré un niveau tendanciel vers une diminution plus importante du score PANSS total médian par rapport à ceux recevant un placebo. Les témoins sains ont obtenu de meilleurs résultats à la fois sur l’encodage et le rappel de la tâche par rapport aux patients (après CBD ou placebo). Les patients sous placebo ont montré une activation accrue par rapport aux témoins dans le gyrus frontal inférieur droit et le gyrus frontal inférieur et moyen gauche pendant le codage, tout en ayant des effets croissants et atténuants dans deux groupes différents dans le gyrus frontal moyen gauche. Une comparaison linéaire entre les trois groupes a montré que les patients sous traitement au CBD avaient une activation intermédiaire dans plusieurs groupes situés bilatéralement dans le gyrus frontal inférieur et le gyrus frontal moyen gauche. Les deux grappes dans le gyrus frontal inférieur droit étaient similaires aux grappes trouvées dans l’analyse placebo vs contrôle (O’Neill et al., 2020). Au cours du rappel, les patients sous placebo ont montré une activation accrue par rapport aux témoins sains dans le gyri frontal droit et inférieur et l’hippocampe droit, mais une activation réduite dans l’hippocampe gauche. Des grappes similaires ont été trouvées dans toutes ces zones, de sorte que le CBD avait une activation intermédiaire par rapport au groupe placebo et au groupe témoin. Les patients sous placebo ont présenté une connectivité accrue entre l’hippocampe et la tête caudé droite et le corps caudé gauche pendant les conditions de rappel. Le CBD avait une connectivité fonctionnelle intermédiaire par rapport aux deux autres groupes dans les connexions entre l’hippocampe et la tête caudé droite, le corps caudé gauche et le putamen gauche (O’Neill et al., 2020).
Crippa et al. (2011) ont étudié l’effet aigu d’une dose orale de 400 mg de CBD chez 10 patients naïfs de médicaments souffrant de troubles d’anxiété sociale, tout en utilisant 99Imagerie TEMP mTc-ECD pour mesurer le débit sanguin cérébral dans une conception intra-sujet. Par rapport au placebo, le CBD a diminué l’anxiété subjective et le flux sanguin dans un groupe composé du gyrus parahippocampique gauche et de l’hippocampe, mais a amélioré le flux sanguin dans le gyrus cingulaire postérieur droit (Crippa et al., 2011).
Pretsch et al. (2019) ont étudié les effets aigus de 600 mg de CBD sur 17 patients atteints de troubles du spectre autistique et 17 témoins sains. La spectroscopie par résonance magnétique a été utilisée pour mesurer les niveaux de glutamate et de glutamine (Glx) et d’acide γ-aminobutyrique inhibiteur et de macromolécules (GABA+) dans deux voxels placés dans les noyaux gris centraux et le cortex préfrontal dorsomédian. Les deux groupes ont reçu un placebo et du CBD. L’effet du CBD sur les niveaux de Glx a montré le même schéma chez les patients et les témoins: le CBD a augmenté les niveaux de Glx par rapport à la ligne de base dans les noyaux gris centraux et a diminué les niveaux de Glx dans le cortex préfrontal. Cependant, les effets du CBD sur les niveaux de GABA + ont montré une tendance opposée entre les groupes: les niveaux de GABA + dans les noyaux gris centraux et le cortex préfrontal ont augmenté dans le groupe témoin après l’administration de CBD mais ont diminué chez les patients autistes (Pretzsch et al., 2019).
En résumé, les effets cérébraux aigus après l’administration de CBD étaient différents chez les patients atteints d’un trouble psychiatrique par rapport aux témoins sains. Chez les sujets au CHR pour la psychose, l’administration de CBD a montré une activité intermédiaire dans les zones du cerveau impliquées dans le traitement de la mémoire et de la récompense par rapport au placebo et aux témoins sains. Une activité intermédiaire a également été rapportée chez des patients atteints de psychose après l’administration de CBD au cours d’une tâche de mémoire. Le CBD a également modifié l’activité limbique chez les sujets souffrant d’anxiété sociale et a montré des schémas similaires (glutamate) et opposés (GABA) des niveaux de métabolites chez les patients autistes par rapport aux témoins sains.
Discussion
La présente revue fournit un aperçu systématique de la littérature des études qui ont étudié les effets aigus du CBD sur le cerveau humain de volontaires sains et de personnes diagnostiquées avec un trouble psychiatrique. Dans l’ensemble, des études chez des sujets sains ont montré que le CBD modulait l’activité cérébrale et avait des effets opposés par rapport au THC au repos et au cours de plusieurs paradigmes cognitifs (saillance, émotion, mémoire, inhibition de la réponse, traitement auditif / visuel), suivant des schémas d’activation spécifiques à la tâche. L’administration aiguë de CBD a également modulé l’activité cérébrale chez les patients atteints de troubles psychiatriques en 1) montrant une activité intermédiaire par rapport au placebo et des témoins sains chez les individus au CHR et présentant une psychose établie, 2) s’engageant dans une activité limbique au repos chez les sujets souffrant de troubles anxieux, et 3) présentant des niveaux de métabolites similaires (glutamate) et opposés (GABA) chez les patients autistes par rapport aux témoins sains.
L’administration aiguë de CBD chez des volontaires sains a modulé les réseaux pertinents pour les troubles psychiatriques au repos et plusieurs tâches cognitives, telles que les circuits fronto-striatal et fronto-limbique. La connectivité fronto-striatale a été améliorée après l’administration de CBD au repos (Grimm et al., 2018) et l’activité a augmenté pendant le traitement de saillance (Bhattacharyya et al., 2015). Fait intéressant, une connectivité fonctionnelle plus faible dans les circuits fronto-striataux a été signalée dans la psychose et a été associée à des symptômes positifs plus graves (Fornito et al., 2013). De plus, le CBD a diminué l’activité fronto-limbique pendant l’état de repos (Crippa et al., 2004) et le traitement émotionnel (Fusar-Poli et al., 2010). Des études fonctionnelles d’IRMf ont montré l’activation des zones limbiques dans les troubles anxieux (p. ex. pendant les attaques de panique ou l’anticipation de la panique) (Pfleiderer et coll., 2007; Dresler et coll., 2013). Sur la base d’un compte rendu mécaniste de ces réseaux, ces résultats suggèrent que le CBD pourrait s’avérer utile comme traitement en restaurant des réseaux déséquilibrés dans ces troubles neurologiques et probablement d’autres (Nenert et al., 2020) et psychiatriques, tels que les troubles liés à l’utilisation de substances (Freeman et al., 2020). En ce qui concerne ce dernier, des preuves précliniques et cliniques convergentes ont montré des effets prometteurs du CBD sur la réduction de l’envie, des effets négatifs et de la motivation à consommer des substances (Chye et al., 2019; Hurd et coll., 2019; Freeman et coll., 2020; Spanagel, 2020), phénomènes associés aux déséquilibres des réseaux fronto-striatal et limbique (Koob et Volkow, 2016 ; Volkow et Boyle, 2018).
Dans le même ordre d’idées, le CBD a également montré des effets opposés à ceux du THC au repos et de plusieurs paradigmes cognitifs chez des volontaires sains. On sait que le THC a des propriétés propsychotiques et anxiogènes, particulièrement évidentes avec les variétés de cannabis à forte puissance (riches en THC) et à fortes doses (Campeny et coll., 2020; Van der Steur et coll., 2020). Des effets neurophysiologiques opposés ont été rapportés sur les zones préfrontales, striatales et limbiques, qui sont des substrats neuronaux pertinents de la psychose et de l’anxiété, et au cours de plusieurs processus cognitifs, tels que la saillance, la mémoire verbale, l’inhibition de la réponse, le traitement émotionnel et le traitement auditif / visuel. Fait important, l’activité du striatum était corrélée à la gravité des symptômes psychotiques après le THC (Bhattacharyya et coll., 2010; Bhattacharyya et coll., 2012b) et l’activité divergente de l’amygdale étaient corrélées à la gravité de l’anxiété après le CBD et le THC (Bhattacharyya et coll., 2010). Ces effets cérébraux opposés peuvent donc sous-tendre la base neuronale des propriétés antipsychotiques et anxiolytiques du CBD, et suggèrent que le CBD pourrait être en mesure de contrebalancer les effets induits par le THC (Colizzi et Bhattacharyya, 2017). Cependant, les concentrations de CBD nécessaires pour compenser les effets du THC chez les individus en bonne santé ne sont toujours pas claires, car le CBD pourrait également avoir des effets différents lorsqu’il est administré à différentes doses (Solowij et al., 2019).
L’administration aiguë de CBD a également affecté les réseaux cérébraux de sujets diagnostiqués avec un trouble psychiatrique. Chez les personnes au CHR pour psychose, le CBD a montré une activité intermédiaire par rapport aux patients recevant un placebo et aux sujets sains dans les régions impliquées dans le traitement de la récompense et de la saillance (Bhattacharyya et al., 2018; Wilson et coll., 2019). Une activité intermédiaire similaire a été rapportée chez des sujets atteints de psychose établie au cours d’une tâche de mémoire (O’Neill et coll., 2020). Ces résultats sont cohérents avec l’activité accrue observée dans les régions fronto-striatales chez les sujets sains après le CBD (Bhattacharyya et al., 2015; Grimm et coll., 2018). Dans l’ensemble, ces résultats suggèrent que le CBD pourrait contribuer à normaliser l’activité fronto-striatale déséquilibrée chez les patients atteints de CHR ou présentant une psychose établie. En outre, Crippa et ses collègues ont montré que le CBD réduisait le flux sanguin cérébral dans les zones (para) limbiques (hippocampe, parahippocampe et gyrus temporal inférieur) chez les sujets souffrant d’anxiété sociale (Crippa et al., 2011). Cela concorde avec la diminution de l’activité fronto-limbique chez les personnes en bonne santé signalée après le CBD (Crippa et coll., 2004; Fusar-Poli et al., 2010), et suggèrent que les effets anxiolytiques du CBD peuvent être liés à la capacité de ce composé à modifier l’activité cérébrale dans les zones (para) limbiques (Crippa et al., 2011). Enfin, une étude de spectroscopie dans les troubles du spectre autistique et les témoins sains a montré des effets similaires du glutamate (c’est-à-dire une augmentation des noyaux gris centraux et une diminution du cortex préfrontal dans les deux groupes) et des effets opposés au GABA (c.-à-d. diminution des niveaux chez les patients et augmentation des contrôles dans les noyaux gris centraux et le cortex préfrontal) après l’administration de CBD (Pretzsch et al., 2019 ). Cette étude ajoute aux preuves précliniques que le CBD peut moduler l’activité d’autres neurotransmetteurs, même après une dose unique (Crippa et al., 2018). Cela a des implications pour l’homéostasie d’autres systèmes de neurotransmetteurs, tels que le glutamate, le GABA et la dopamine. Cependant, les mécanismes moléculaires sous-jacents expliquant la relation entre le CBD et d’autres neurotransmetteurs doivent être étudiés plus avant.
L’un de ces mécanismes moléculaires peut impliquer la capacité du CBD à inhiber directement la recapture de l’anandamide. Cet endocannabinoïde a montré une activité anti-inflammatoire (Pisanti et al., 2017), et son augmentation après que le CBD a été liée à des effets antipsychotiques (Leweke et al., 2012; Rohleder et coll., 2016). Parce que les endocannabinoïdes agissent comme des messagers rétrogrades, il a été émis l’hypothèse que l’augmentation des concentrations d’endocannabinoïdes après le CBD pourrait atténuer la libération présynaptique de GABA et de glutamate, ainsi que stabiliser la neurotransmission de la dopamine (Gururajan et Malone, 2016). De plus, la plupart des effets rapportés après l’administration de CBD se sont produits dans des zones cérébrales riches en CB.1 (Burns et coll., 2007). La consommation chronique de cannabis est associée à une réduction des cannabinoïdes endogènes et à une régulation négative du CB1 (Hirvonen et coll., 2012; Morgan et coll., 2013), tandis que les effets antagonistes du CBD pourraient être liés à la modulation des récepteurs cannabinoïdes en se liant à un site allostérique distinct (Laprairie et coll., 2015). Étant donné que le CBD peut atténuer les effets du THC, il a également été spéculé que le CBD pourrait être en mesure d’empêcher la régulation négative du CB1 à long terme, et ainsi diminuer le risque de développer une psychose et/ou des troubles liés à l’utilisation de substances (Wall et coll., 2019). D’autres mécanismes d’action possibles du CBD impliquent son activité agoniste vers le 5HT1A (Soares et Campos, 2017), l’activité agoniste partielle sur les récepteurs dopaminergiques D2 (Seeman, 2016) et l’activation du récepteur vanilloïde 1, un canal calcique non sélectif, facilitant la libération pré-synaptique de glutamate (Campos et al., 2012).
Cette revue doit être lue avec une série de limitations prises en compte. Premièrement, les articles inclus utilisaient souvent des méthodologies différentes (par exemple, méthode d’imagerie, voie d’administration, doses appliquées), bien que nous ayons utilisé des critères d’inclusion et d’exclusion stricts pour la sélection des articles afin d’éviter une hétérogénéité excessive entre les études. Par exemple, alors que la plupart des études ont administré le CBD et le THC en tant que composés cannabinoïdes individuels lors de séances distinctes (Borgwardt et coll., 2008; Bhattacharyya et coll., 2012b; Grimm et coll., 2018), certaines études ont examiné l’impact du CBD sur la fonction cérébrale en comparant les effets du cannabis contenant uniquement du THC au cannabis contenant à la fois du THC et du CBD (Freeman et coll., 2018; Wall et coll., 2019). En ce qui concerne les différences dans les paradigmes cognitifs appliqués, il est important de noter que les effets décrits sur l’activité cérébrale peuvent dépendre de la nature de la tâche utilisée ou des stimuli présentés, car différentes tâches peuvent provoquer des modèles d’activité cérébrale distincts. Par exemple, alors que les paradigmes de la mémoire peuvent fortement reposer sur le recrutement d’aires temporelles et préfrontales (Bhattacharyya et al., 2009; Bhattacharyya et coll., 2018; O’Neill et coll., 2020), le traitement émotionnel et la saillance impliquent principalement l’activation limbique (Fusar-Poli et coll., 2009; Bhattacharyya et coll., 2012b). Un dernier aspect méthodologique à prendre en compte est que les effets cliniques et cérébraux du CBD peuvent être différents en fonction de l’âge et de la progression de la maladie (Di Marzo et al., 2015; Batalla et coll., 2019; Colizzi et coll., 2020), ou être influencée par l’utilisation concomitante de médicaments (p. ex. antipsychotiques) ou de drogues. Cependant, la conception intra-sujet des études où l’utilisation concomitante de médicaments ou de cannabis était autorisée a probablement atténué ces effets confusionnels (tableau 3). Deuxièmement, la plupart des études incluses ont utilisé des échantillons superposés de sujets sains principalement masculins ou de patients souffrant de troubles psychiatriques pour explorer les effets du CBD. Bien que les études examinées ici offrent une image cohérente indiquant que le CBD a des effets modulateurs sur les réseaux neuronaux pertinents pour la psychose, l’anxiété et la dépendance, cela souligne la nécessité de reproduire les résultats dans des cohortes indépendantes et plus importantes comprenant également des sujets féminins.
Des suggestions peuvent être faites pour de futures recherches sur l’impact du CBD sur le fonctionnement du cerveau. Tout d’abord, étant donné que toutes les études incluses dans la présente revue ont examiné les effets aigus de l’administration de CBD, les recherches futures devraient se concentrer sur le traitement à long terme du CBD chez les patients atteints d’un trouble psychiatrique en combinaison avec des évaluations de neuroimagerie, afin d’élucider les substrats neuronaux sous-jacents aux effets thérapeutiques du CBD. À cet égard, deux excellents exemples d’études en voie d’achèvement sont 1) un traitement au CBD de 3 semaines sur des personnes au CHR pour la psychose (Institute of Psychiatry, King’s College London) et 2) un traitement d’appoint de 4 semaines au CBD de patients à début précoce atteints d’un trouble psychotique (Centre médical universitaire d’Utrecht, Pays-Bas), à la fois en combinaison avec une IRM fonctionnelle de base et de suivi et 1Techniques H-MRS. Deuxièmement, parce qu’il a été démontré que la réponse clinique au CBD diffère d’un patient à l’autre (Batalla et al., 2019), des études futures pourraient également appliquer des techniques de neuroimagerie pour contribuer à l’identification des patients qui pourraient particulièrement bénéficier d’un traitement au CBD.
En conclusion, des études de neuroimagerie ont montré que le CBD module l’activité cérébrale et la connectivité dans les systèmes neuronaux pertinents pour la psychose et l’anxiété, reflétant peut-être les effets thérapeutiques du CBD. Les études futures devraient envisager la réplication des résultats et élargir l’inclusion des patients psychiatriques, en combinant un traitement à long terme au CBD avec des évaluations de neuroimagerie.
Déclaration de disponibilité des données
Les contributions originales présentées dans l’étude sont incluses dans l’article / matériel supplémentaire, d’autres demandes peuvent être adressées à l’auteur correspondant.
Contributions de l’auteur
AB et JB ont effectué la recherche systématique et rédigé le manuscrit, et MB a examiné les publications potentiellement éligibles et révisé de manière critique le manuscrit pour y trouver un contenu intellectuel important. AB, JB, AP et MB ont fourni des révisions critiques pour un contenu intellectuel important et ont contribué de manière significative au manuscrit. Tous les auteurs ont lu et accepté la version publiée du manuscrit.
Conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Matériel supplémentaire
Le matériel supplémentaire pour cet article peut être trouvé en ligne à: https://www.frontiersin.org/articles/10.3389/fphar.2020.618184/full#supplementary-material.
Abréviations:
AIS, échelle d’intoxication; CB1récepteur cannabinoïde 1; CB2récepteur cannabinoïde 2; CBD, cannabidiol; CHR, risque clinique élevé; IRMf, imagerie par résonance magnétique fonctionnelle; GABA, acide γ-aminobutyrique; GPR18, récepteur couplé aux protéines G 18; GPR55, récepteur couplé à la protéine G 55; Glx, glutamate et glutamine; H-MRS, spectroscopie par résonance magnétique protonique; 5HT1Arécepteur de la sérotonine de type 1A; PANNS, échelle des syndromes positifs et négatifs; PPARgamma, récepteur gamma activé par les proliférateurs de peroxysomes; PRISMA, éléments de rapport préférés pour les revues systématiques et les méta-analyses; SPECT, tomodensitométrie par émission monophotonique; STAI, inventaire de l’anxiété des traits d’état; 99mTC-ECD, 99mDimère de cystéinate de tc-éthyle; THC, tétrahydrocannabinol; TRPV1, récepteur transitoire potentiel vanilloïde 1; VAMS, échelles d’humeur analogiques visuelles.
Détails sur l'étude :
L’impact du cannabidiol sur la fonction cérébrale humaine: une revue systématique - PubMed (nih.gov)
Références
Batalla, A., Crippa, J. A., Busatto, G. F., Guimaraes, F. S., Zuardi, A. W., Valverde, O., et coll. (2014). Études de neuroimagerie des effets aigus du THC et du CBD chez les humains et les animaux: une revue systématique. Curr. Pharmaceut. Des. 20, 2168–2185. doi:10.2174/13816128113199990432
Batalla, A., Janssen, H., Gangadin, S. S., et Bossong, M. G. (2019). Le potentiel du cannabidiol comme traitement de la psychose et de la toxicomanie: qui en bénéficie le plus? Une revue systématique. J. Clin. Médi. 8, 1058. doi:10.3390/jcm8071058
Bhattacharyya, S., Atakan, Z., Martin-Santos, R., Crippa, J. A., et Mcguire, P. K. (2012a). Mécanismes neuronaux pour la modulation cannabinoïde de la cognition et de l’affect chez l’homme: une revue critique des études de neuroimagerie. Curr. Pharmaceut. Des. 18, 5045–5054. doi:10.2174/138161212802884636
Bhattacharyya, S., Crippa, J. A., Allen, P., Martin-Santos, R., Borgwardt, S., Fusar-Poli, P., et coll. (2012b). L’induction de la psychose par le Δ9-tétrahydrocannabinol reflète la modulation de la fonction préfrontale et striatale pendant le traitement de la saillance attentionnelle. Arch. Gen. Psychiatr. 69, 27–36. doi:10.1001/archgenpsychiatry.2011.161
Bhattacharyya, S., Falkenberg, I., Martin-Santos, R., Atakan, Z., Crippa, J. A., Giampietro, V., et coll. (2015). Modulation cannabinoïde de la connectivité fonctionnelle dans les régions traitant la saillance attentionnelle, neuropsychopharmacologie. 40, 1343–1352. doi:10.1038/npp.2014.258
Bhattacharyya, S., Fusar-Poli, P., Borgwardt, S., Martin-Santos, R., Nosarti, C., O’carroll, C., et coll. (2009). Modulation de la fonction médiotemporale et ventrostriatale chez l’homme par le delta9-tétrahydrocannabinol: une base neurale pour les effets de Cannabis sativa sur l’apprentissage et la psychose. Arch. Gen. Psychiatr. 66, 442–451. doi:10.1001/archgenpsychiatry.2009.17
Bhattacharyya, S., Morrison, P. D., Fusar-Poli, P., Martin-Santos, R., Borgwardt, S., Winton-Brown, T., et coll. (2010). Effets opposés du delta-9-tétrahydrocannabinol et du cannabidiol sur la fonction cérébrale humaine et la psychopathologie, Neuropsychopharmacologie. 35, 764–774. doi:10.1038/npp.2009.184
Bhattacharyya, S., Wilson, R., Appiah-Kusi, E., O’neill, A., Brammer, M., Perez, J., et coll. (2018). Effet du cannabidiol sur le dysfonctionnement médian temporal, mésencéphale et striatal chez les personnes présentant un risque clinique élevé de psychose: un essai clinique randomisé. JAMA Psychiatrie. 75, 1107–1117. doi:10.1001/jamapsychiatry.2018.2309
Bisogno, T., Hanus, L., De Petrocellis, L., Tchilibon, S., Ponde, D. E., Brandi, I., et coll. (2001). Cibles moléculaires du cannabidiol et de ses analogues synthétiques: effet sur les récepteurs vanilloïdes VR1 et sur l’absorption cellulaire et l’hydrolyse enzymatique de l’anandamide. Fr. J. Pharmacol. 134, 845–852. doi:10.1038/sj.bjp.0704327
Blessing, E. M., Steenkamp, M. M., Manzanares, J., et Marmar, C. R. (2015). Cannabidiol comme traitement potentiel pour les troubles anxieux. Neurotherapeutics. 12, 825–836. doi:10.1007/s13311-015-0387-1
Borgwardt, S. J., Allen, P., Bhattacharyya, S., Fusar-Poli, P., Crippa, J. A., Seal, M. L., et coll. (2008). Base neurale du delta-9-tétrahydrocannabinol et du cannabidiol: effets pendant l’inhibition de la réponse. Biol. Psychiatr. 64, 966–973. doi:10.1016/j.biopsych.2008.05.011
Burns, H. D., Van Laere, K., Sanabria-Bohórquez, S., Hamill, T. G., Bormans, G., Eng, W. S., et coll. (2007). [18F] MK-9470, un traceur de tomographie par émission de positrons (TEP) pour l’imagerie cérébrale in vivo du récepteur cannabinoïde-1 par TEP humaine. Proc. Natl. Acad. Sci. U.S.A. 104, 9800–9805. doi:10.1073/pnas.0703472104
Campeny, E., Lopez-Pelayo, H., Nutt, D., Blithikioti, C., Oliveras, C., Nuno, L., et coll. (2020). Les aveugles et l’éléphant : revue systématique des revues systématiques des méfaits de la santé liés à la consommation de cannabis. Eur. Neuropsychopharmacol. 33, 1–35.
Campos, A. C., Moreira, F. A., Gomes, F. V., Del Bel, E. A., et Guimarães, F. S. (2012). Mécanismes multiples impliqués dans le potentiel thérapeutique à large spectre du cannabidiol dans les troubles psychiatriques. Philos. Trad. R. Soc. Lond. B Biol. Sci. 367, 3364–3378. doi:10.1098/rstb.2011.0389
Chye, Y., Christensen, E., Solowij, N., et Yücel, M. (2019). Le système endocannabinoïde et la promesse du cannabidiol pour le traitement des troubles liés à l’utilisation de substances. Devant. Psychiatre. 10, 63. doi:10.3389/fpsyt.2019.00063
Colizzi, M., et Bhattacharyya, S. (2017). La composition du cannabis est-elle importante? Effets différentiels du delta-9-tétrahydrocannabinol et du cannabidiol sur la cognition humaine. Curr. Toxicomane. Rép. 4, 62–74. doi:10.1007/s40429-017-0142-2
Colizzi, M., Ruggeri, M., et Bhattacharyya, S. (2020). Démêler les effets enivrants et thérapeutiques des ingrédients du cannabis sur la psychose et la cognition. Devant. Psychol. 11, 833. doi:10.3389/fpsyg.2020.00833
Crippa, J. A., Derenusson, G. N., Ferrari, T. B., Wichert-Ana, L., Duran, F. L., Martin-Santos, R., et coll. (2011). Base neurale des effets anxiolytiques du cannabidiol (CBD) dans le trouble d’anxiété sociale généralisée: un rapport préliminaire. J. Psychopharmacol. 25, 121–130. doi:10.1177/0269881110379283
Crippa, J. A., Guimaraes, F. S., Campos, A. C., et Zuardi, A. W. (2018). Étude translationnelle du potentiel thérapeutique du cannabidiol (CBD) : vers une nouvelle ère. Devant. Immunol. 9, 2009. doi:10.3389/fimmu.2018.02009
Crippa, J. A., Zuardi, A. W., Garrido, G. E., Wichert-Ana, L., Guarnieri, R., Ferrari, L., et coll. (2004). Effets du cannabidiol (CBD) sur le flux sanguin cérébral régional, Neuropsychopharmacologie. 29, 417–426. doi:10.1038/sj.npp.1300340
Di Marzo, V., Stella, N., et Zimmer, A. (2015). La signalisation endocannabinoïde et la détérioration du cerveau. Révérend nat. Neurosci. 16, 30–42. doi:10.1038/nrn3876
Dresler, T., Guhn, A., Tupak, S. V., Ehlis, A. C., Herrmann, M. J., Fallgatter, A. J., et coll. (2013). Réviser la version révisée? Nouvelles dimensions de l’hypothèse neuroanatomique du trouble panique. J. Neural. Transm. 120, 3–29. doi:10.1007/s00702-012-0811-1
Fornito, A., Harrison, B. J., Goodby, E., Dean, A., Ooi, C., Nathan, P. J., et coll. (2013). Dysconnectivité fonctionnelle des circuits corticostriataux comme phénotype de risque de psychose. JAMA Psychiatrie. 70, 1143–1151. doi:10.1001/jamapsychiatry.2013.1976
Freeman, T. P., Hindocha, C., Baio, G., Shaban, N. D. C., Thomas, E. M., Astbury, D., et coll. (2020). Cannabidiol pour le traitement des troubles liés à la consommation de cannabis : essai bayésien adaptatif de phase 2a, en double aveugle, contrôlé par placebo, randomisé. Lancet Psychiatrie. 7, 865–874. doi:10.1016/S2215-0366(20)30290-X
Freeman, T. P., Hindocha, C., Green, S. F., et Bloomfield, M. A. P. (2019). Usage médical de produits à base de cannabis et de cannabinoïdes. BMJ. 365, L1141. doi:10.1136/bmj.l1141
Freeman, T. P., Pope, R. A., Wall, M. B., Bisby, J. A., Luijten, M., Hindocha, C., et coll. (2018). Le cannabis atténue les effets de la musique dans les régions du cerveau sensibles à la récompense et à l’émotion. J. Neuropsychopharmacol. 21, 21–32. doi:10.1093/ijnp/pyx082
Fusar-Poli, L., Cavone, V., Tinacci, S., Concas, I., Petralia, A., Signorelli, M. S., et al. (2020). Cannabinoïdes pour les personnes atteintes de TSA: une revue systématique des études publiées et en cours. Brain Sci. 10, 572. doi:10.3390/brainsci10090572
Fusar-Poli, P., Allen, P., Bhattacharyya, S., Crippa, J. A., Mechelli, A., Borgwardt, S., et coll. (2010). Modulation de la connectivité efficace pendant le traitement émotionnel par Delta 9-tétrahydrocannabinol et cannabidiol. J. Neuropsychopharmacol. 13, 421–432. doi:10.1017/S1461145709990617
Fusar-Poli, P., Crippa, J. A., Bhattacharyya, S., Borgwardt, S. J., Allen, P., Martin-Santos, R., et coll. (2009). Effets distincts du {delta}9-tétrahydrocannabinol et du cannabidiol sur l’activation neuronale pendant le traitement émotionnel. Arch. Psychiatrie générale. 66, 95–105. doi:10.1001/archgenpsychiatry.2008.519
Grimm, O., Löffler, M., Kamping, S., Hartmann, A., Rohleder, C., Leweke, M., et coll. (2018). Sonder le système endocannabinoïde chez des volontaires sains: le cannabidiol modifie la connectivité fronto-striatale au repos. Eur. Neuropsychopharmacol. 28, 841–849. doi:10.1016/j.euroneuro.2018.04.004
Gururajan, A., et Malone, D. T. (2016). Le cannabidiol joue-t-il un rôle dans le traitement de la schizophrénie? Schizophr. Rés. 176, 281–290. doi:10.1016/j.schres.2016.06.022
Hirvonen, J., Goodwin, R. S., Li, C. T., Terry, G. E., Zoghbi, S. S., Morse, C., et coll. (2012). Régulation négative réversible et sélective régionale des récepteurs CB1 des cannabinoïdes cérébraux chez les fumeurs quotidiens chroniques de cannabis. Mol. Psychiatrie. 17, 642–649. doi:10.1038/mp.2011.82
Hurd, Y. L., Spriggs, S., Alishayev, J., Winkel, G., Gurgov, K., Kudrich, C., et coll. (2019). Cannabidiol pour la réduction de l’envie et de l’anxiété induites par les signaux chez les personnes abstinentes de drogues atteintes de troubles liés à la consommation d’héroïne: un essai randomisé à double insu contrôlé par placebo. Am. J. Psychiatrie. 176, 911–922. doi:10.1176/appi.ajp.2019.18101191
Iseger, T. A., et Bossong, M. G. (2015). Une revue systématique des propriétés antipsychotiques du cannabidiol chez l’homme. Schizophr. Rés. 162, 153–161. doi:10.1016/j.schres.2015.01.033
Jones, N. A., Hill, A. J., Smith, I., Bevan, S. A., Williams, C. M., Whalley, B. J., et coll. (2010). Le cannabidiol présente des propriétés antiépileptiformes et anticonvulsives in vitro et in vivo. J. Pharmacol. Exp. Therapeut. 332, 569–577. doi:10.1124/jpet.109.159145
Koob, G. F., et Volkow, N. D. (2016). Neurobiologie de la toxicomanie: une analyse neurocircuitaire. Lancet Psychiatrie. 3, 760–773. doi:10.1016/S2215-0366(16)00104-8
Lally, J., et Maccabe, J. H. (2015). Médicaments antipsychotiques dans la schizophrénie: une revue. Fr. Med. Bull. 114, 169–179. doi:10.1093/bmb/ldv017
Laprairie, R. B., Bagher, A. M., Kelly, M. E., et Denovan-Wright, E. M. (2015). Le cannabidiol est un modulateur allostérique négatif du récepteur cannabinoïde CB1. Fr. J. Pharmacol. 172, 4790–4805. doi:10.1111/bph.13250
Leucht, S., Cipriani, A., Spineli, L., Mavridis, D., Orey, D., Richter, F., et coll. (2013). Efficacité comparative et tolérabilité de 15 médicaments antipsychotiques dans la schizophrénie: une méta-analyse de traitements multiples. Lancet. 382, 951–962. doi:10.1016/S0140-6736(13)60733-3
Leweke, F. M., Giuffrida, A., Koethe, D., Schreiber, D., Nolden, B. M., Kranaster, L., et coll. (2007). Taux d’anandamide dans le liquide céphalorachidien des patients schizophrènes présentant un premier épisode : impact de la consommation de cannabis. Schizophr. Rés. 94, 29–36. doi:10.1016/j.schres.2007.04.025
Leweke, F. M., Piomelli, D., Pahlisch, F., Muhl, D., Gerth, C. W., Hoyer, C., et coll. (2012). Le cannabidiol améliore la signalisation de l’anandamide et soulage les symptômes psychotiques de la schizophrénie. Trad. Psychiatrie. 2, e94. doi:10.1038/tp.2012.15
Martín-Santos, R., Fagundo, A. B., Crippa, J. A., Atakan, Z., Bhattacharyya, S., Allen, P., et coll. (2010). Neuroimaging in cannabis use: a systematic review of the literature. Psychol. Med. 40, 383–398. doi:10.1017/S0033291709990729
Minichino, A., Senior, M., Brondino, N., Zhang, S. H., Godwlewska, B. R., Burnet, P. W. J., et coll. (2019). Mesure de la perturbation du système endocannabinoïde dans la psychose: une revue systématique et une méta-analyse. JAMA Psychiatrie. 76, 914–923. doi:10.1001/jamapsychiatry.2019.0970
Moher, D., Liberati, A., Tetzlaff, J., et Altman, D. G. (2009). Réimpression - éléments de rapport préférés pour les revues systématiques et les méta-analyses : la déclaration PRISMA. Phys. 89, 873–880. doi:10.1093/ptj/89.9.873
Morgan, C. J., Page, E., Schaefer, C., Chatten, K., Manocha, A., Gulati, S., et al. (2013). Cerebrospinal fluid anandamide levels, cannabis use and psychotic-like symptoms. Br. J. Psychiatry. 202, 381–382. doi:10.1192/bjp.bp.112.121178
Nenert, R., Allendorfer, J. B., Bebin, E. M., Gaston, T. E., Grayson, L. E., Houston, J. T., et al. (2020). Cannabidiol normalizes resting-state functional connectivity in treatment-resistant epilepsy. Epilepsy Behav. 112, 107297. doi:10.1016/j.yebeh.2020.107297
O’neill, A., Wilson, R., Blest-Hopley, G., Annibale, L., Colizzi, M., Brammer, M., et al. (2020). Normalization of mediotemporal and prefrontal activity, and mediotemporal-striatal connectivity, may underlie antipsychotic effects of cannabidiol in psychosis. Psychol. Med. 2020, 1–11. doi:10.1002/central/CN-02086740/full
Pertwee, R. G. (2008). Ligands that target cannabinoid receptors in the brain: from THC to anandamide and beyond. Addiction Biol. 13, 147–159. doi:10.1111/j.1369-1600.2008.00108.x
Pfleiderer, B., Zinkirciran, S., Arolt, V., Heindel, W., Deckert, J., and Domschke, K. (2007). fMRI amygdala activation during a spontaneous panic attack in a patient with panic disorder. World J. Biol. Psychiatr. 8, 269–272. doi:10.1080/15622970701216673
Pisanti, S., Malfitano, A. M., Ciaglia, E., Lamberti, A., Ranieri, R., Cuomo, G., et al. (2017). Cannabidiol: state of the art and new challenges for therapeutic applications. Pharmacol. Ther. 175, 133–150. doi:10.1016/j.pharmthera.2017.02.041
Poleg, S., Golubchik, P., Offen, D., and Weizman, A. (2019). Cannabidiol as a suggested candidate for treatment of autism spectrum disorder. Prog. Neuropsychopharmacol. Biol. Psychiatry. 89, 90–96. doi:10.1016/j.pnpbp.2018.08.030
Pretzsch, C. M., Freyberg, J., Voinescu, B., Lythgoe, D., Horder, J., Mendez, M. A., et al. (2019). Effects of cannabidiol on brain excitation and inhibition systems; a randomised placebo-controlled single dose trial during magnetic resonance spectroscopy in adults with and without autism spectrum disorder. Neuropsychopharmacology. 44, 1398–1405. doi:10.1038/s41386-019-0333-8
Rohleder, C., Müller, J. K., Lange, B., et Leweke, F. M. (2016). Le cannabidiol comme un nouveau type potentiel d’antipsychotique. Un examen critique des preuves. Devant. Pharmacol. 7, 422. doi:10.3389/fphar.2016.00422
Samara, M. T., Nikolakopoulou, A., Salanti, G., et Leucht, S. (2019). Combien de patients atteints de schizophrénie ne répondent pas aux médicaments antipsychotiques à court terme? Une analyse basée sur les données individuelles des patients provenant d’essais contrôlés randomisés. Schizophr. Bull. 45, 639–646. doi:10.1093/schbul/sby095
Seeman, P. (2016). Le cannabidiol est un agoniste partiel des récepteurs dopaminergiques D2High, prédisant sa dose clinique antipsychotique. Trad. Psychiatrie. 6, e920. doi:10.1038/tp.2016.195
Soares, V. P., et Campos, A. C. (2017). Preuves des actions anti-panique du cannabidiol. Curr. Neuropharmacol. 15, 291–299. doi:10.2174/1570159x14666160509123955
Solowij, N., Broyd, S., Greenwood, L. M., Van Hell, H., Martelozzo, D., Rueb, K., et coll. (2019). Un essai contrôlé randomisé portant sur le delta(9)-tétrahydrocannabinol vaporisé et le cannabidiol seuls et en association chez des consommateurs fréquents et peu fréquents de cannabis : effets d’intoxication aiguë. Eur. Arch. Psychiatrie Clin. Neurosci. 269, 17–35. doi:10.1007/s00406-019-00978-2
Spanagel, R. (2020). Les cannabinoïdes et le système endocannabinoïde dans le traitement de la récompense et la dépendance : des mécanismes aux interventions. Dialogues Clin. Neurosci. 22, 241–250. doi:10.31887/DCNS.2020.22.3/rspanagel
Thomas, A., Baillie, G. L., Phillips, A. M., Razdan, R. K., Ross, R. A., et Pertwee, R. G. (2007). Le cannabidiol affiche une puissance étonnamment élevée en tant qu’antagoniste des agonistes des récepteurs CB1 et CB2 in vitro. Fr. J. Pharmacol. 150, 613–623. doi:10.1038/sj.bjp.0707133
Van der Steur, S. J., Batalla, A., et Bossong, M. G. (2020). Facteurs modérant l’association entre la consommation de cannabis et le risque de psychose : une revue systématique. Brain Sci. 10, 97. doi:10.3390/brainsci10020097
Volkow, N. D., et Boyle, M. (2018). Neuroscience de la toxicomanie: pertinence pour la prévention et le traitement. Am. J. Psychiatr. 175, 729–740. doi:10.1176/appi.ajp.2018.17101174
Wall, M. B., Pope, R., Freeman, T. P., Kowalczyk, O. S., Demetriou, L., Mokrysz, C., et coll. (2019). Effets dissociables du cannabis avec et sans cannabidiol sur la connectivité fonctionnelle du cerveau humain à l’état de repos. J. Psychopharmacol. 33, 822–830. doi:10.1177/0269881119841568
Weinstein, A., Livny, A., et Weizman, A. (2016). Études d’imagerie cérébrale sur les effets cognitifs, pharmacologiques et neurobiologiques du cannabis chez l’homme : données probantes provenant d’études sur des consommateurs adultes. Curr. Pharmaceut. Des. 22, 6366–6379. doi:10.2174/1381612822666160822151323
Wilson, R., Bossong, M. G., Appiah-Kusi, E., Petros, N., Brammer, M., Perez, J., et coll. (2019). Le cannabidiol atténue le dysfonctionnement insulaire pendant le traitement de la saillance motivationnelle chez les sujets présentant un risque clinique élevé de psychose. Trad. Psychiatrie. 9, 203. doi:10.1038/s41398-019-0534-2